
内脂骨架,尤其是五元环异苯并呋喃酮类和六元环异香豆素类化合物,存在于很多特殊的天然产物和生物活性物质中,它们表现出了广泛的生物和药理活性。因此,许多实用的合成方法被开发出来用于构建此类化合物骨架。其中,以 2-烯基苯甲酸为原料通过氧化环合和官能团化的策略构建五元环异苯并呋喃酮骨架已被广泛探索。
在近些年来,高价碘试剂由于其反应条件温和,反应活性高、低毒性及环境友好型的特点,在有机合成领域取得了快速的发展。在之前的报道的方法中我们发现,当合适的高价碘试剂应用于该类底物的反应中,除了常见的内脂化和官能团化以外,还伴随着特殊的 1,2-芳基迁移重排反应。
虽然这些方法能够构建具有手性碳中心的异苯并呋喃酮骨架,但这些方法的共同特点是形成外消旋产物。就这一点而言,如果能够开发合成相应的具有前手性碳中心的异苯呋喃酮衍生物的方法,可以为进一步的不对称转化提供了更多的可能性,这或许更具有探索价值。

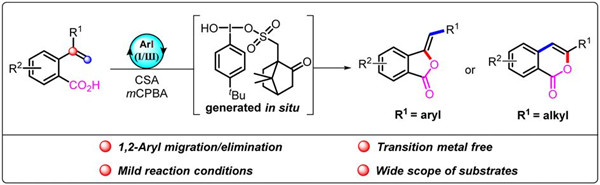
基于上述背景,我院副院长杜云飞教授课题组报道了一个以 2-烯基苯甲酸为原料,通过芳基碘化合物催化的级联转化,包括内酯化、1,2-芳基迁移和消除过程。与上述报道的方法不同的是,采用此策略可以通过反应底物中R1取代基为芳基或烷基,实现具有环外碳-碳双键的异苯并呋喃酮产物和异香豆素类产物的可调控合成。
课题组首先对反应条件进行了筛选,结果表明以1,2-二氯乙烷 (DCE) 为溶剂,对叔丁基碘苯 I4作为催化剂,搭配外源氧化剂间氯过氧苯甲酸(mCPBA),樟脑磺酸(CSA)和分子筛在室温下反应效果最好。
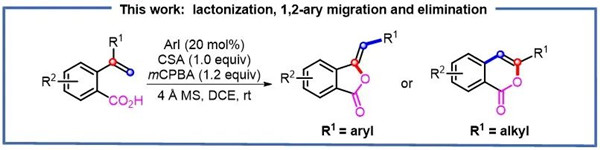
在获得了上述最佳条件之后,课题组对底物的适用范围进行了研究。首先,当取代基R1是芳香结构时,底物也表现出很好的耐受性,一系列吸电子基团和给电子基团取代的底物均能实现转化,得到芳香基团R1发生 1,2-芳基迁移的五元环异苯并呋喃酮类产物 2。值得注意的是,这类转化不适应于4-苯基-4-戊烯酸(1v)这类简单的不饱和羧酸底物。
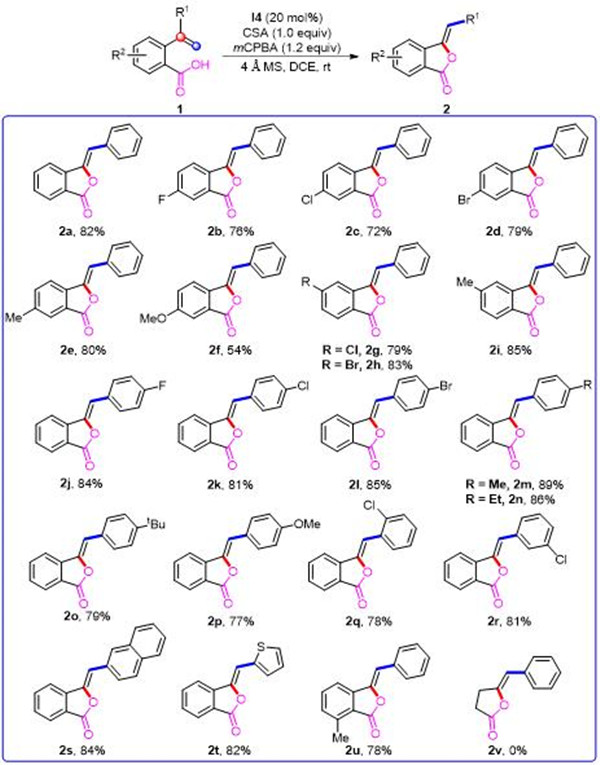
随后,课题组继续探索了底物中烯基部分的取代基效应。当取代基R1 是甲基时,并没有得到期望的1,2-烷基迁移产生的异苯并呋喃酮产物。而是得到了苯甲酸骨架的芳基发生1,2-迁移的六元环异香豆素类产物 3a。
当底物含有其他烷基取代基时,包括乙基、异丙基、叔丁基和环己基等结构,均能够以较好的收率转化为目标产物。此外,苯甲酸骨架的取代基效应研究显示,底物对于给电子和吸电子的R2基团都具有良好的耐受性。但当取代基的吸电子性较强时,会抑制该类转化的发生。
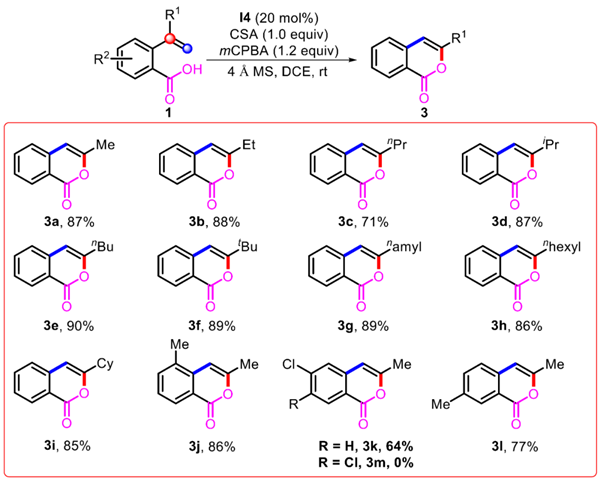
该反应由一种改良的 Koser 试剂 HCIB 介导转化发生。值得一提的是这个关键的高价碘物质采用了由芳基碘化合物作为催化剂,搭配外源氧化剂间氯过氧苯甲酸 (mCPBA) 和活化剂樟脑磺酸 (CSA) 的方法原位生成。
为了验证这种转化的反应机理,课题组在控制实验中对催化剂芳基碘苯和活化剂樟脑磺酸对该转化发生的必要性进行了验证,结果证明二者任何一种的缺失都会抑制该转化。并且通过便捷的一锅法合成了高价碘化合物 HCIB,并对其结构进行了 X-ray 晶体衍射表征;同时应用于反应底物 1a 的结果证实了介导该转化发生的关键物质正是反应体系中原位生成的 HCIB。
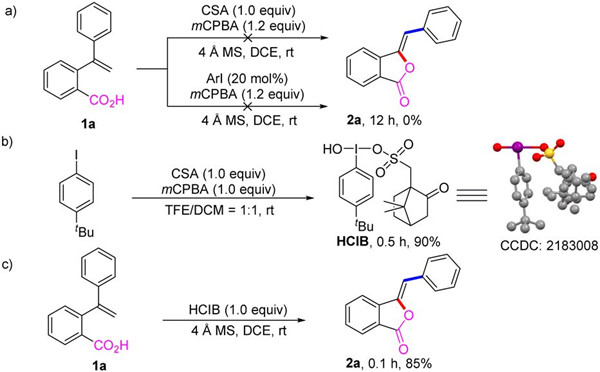
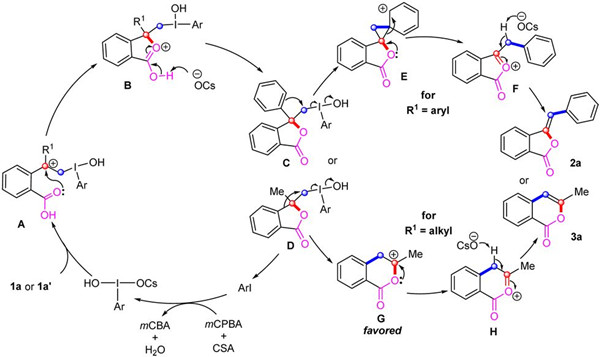
结合控制实验的结果和之前的报道,课题组提出了异苯并呋喃酮和异香豆素类衍生物的可调控合成的机理。首先,预催化剂芳基碘苯与间氯过氧苯甲酸 (mCPBA) 在樟脑磺酸 (CSA) 存在下氧化生成高价碘化合物 HCIB。然后,底物中烯烃的碳碳双键与高价碘进行亲电加成,形成碳正离子 A。随后羰基氧原子对碳正离子的亲核进攻形成氧鎓离子 B,经过去氢化得到中间体 C 或 D。当R1为芳基时,R1发生1,2-芳基迁移到邻近的碳原子,形成了共振稳定的苯鎓离子中间体 E。然后 E 中的环丙烷部分开环得到中间体 F,在樟脑磺酸根负离子的去氢作用下,经过反式消除得到 Z-构型异苯并呋喃酮产物 2a。对于R1为烷基时,在中间体 D 中,并没有出现烷基迁移得到异苯并呋喃酮产物,而是芳香骨架发生1,2-芳基迁移形成了中间体 G,最终通过去氢化得到异香豆素产物 3a。
综上所述,课题组开发了一种以芳基碘苯为催化剂,在外源氧化剂 (mCPBA) 和活化剂 (CSA) 作用下原位生成高价碘试剂,实现了异苯并呋喃酮和异香豆素类衍生物可调控合成。反应过程中伴随的 1,2-芳基迁移和消除过程是实现此转化的关键步骤。该论文以“Aryl iodine-catalysed divergent synthesis of isobenzofuranones and isocoumarins via oxidative 1,2-aryl migration/elimination”为题发表于 Chemical Communications.
Jiaxin He (何嘉鑫,天津大学), Jingran Zhang, Xuemin Li, Haofeng Shi and Yunfei Du*(杜云飞,天津大学)Chem. Commun., 2022,58,9096 https://doi.org/10.1039/D2CC03101A.


